
Der konzeptuelle Aufbau des SFB 1280

Der SFB 1280 bringt Arbeitsgruppen zusammen, die scheinbar unterschiedlich sind. Ihre Gemeinsamkeiten sind in verbindenden Fragestellungen festgehalten: in sieben Arbeitshypothesen, die von allen Teilprojekten aus ihren verschiedenen Perspektiven heraus erforscht werden. Diese Hypothesen geben einen konzeptuellen Rahmen vor und sind das experimentelle Ziel aller Arbeitsgruppen. Ergänzt wird dieser Rahmen durch zusätzliche Hypothesen der beiden Fokusgruppen, welche sich in die Themen „learning dynamics“ und „neuroimaging“ vertiefen.
Sowohl eine erlernte Inhibition als auch das Vergessen charakterisieren das Extinktionslernen als parallele Ereignisse.
Das Wesen des Extinktionslernens
Die Ergebnisse der Verhaltensstudien zum Extinktionslernen werden in der Regel so interpretiert, dass sie entweder ein Verlernen (oder Vergessen) der CS-US-Vereinigung oder einen Inhibitionserwerb widerspiegeln, der das zuvor erworbene Verhalten hemmt. Die Abbildung zeigt die beiden theoretischen Positionen als positive oder negative Exponentialkurve für die assoziative Stärke über die Versuchsdurchgänge. Ergänzt werden die Kurven von schematischen Darstellungen der Spike-Frequenzveränderungen der BLA-Neuronen innerhalb der Amygdala von Nagetieren während des initialen Erwerbs und des späteren Extinktionslernens. Dabei werden die Kurven dieser Veränderungen in idealisierter Form gezeigt. Es ist zu sehen, dass die elektrophysiologischen Daten aus dem BLA perfekt mit den Vorhersagen aus der Lerntheorie übereinstimmen. Dabei wirkt sich elektrophysiologische Erkenntnis sich auf die Lerntheorie aus: Es könnte somit bedeuten, dass das Extinktionslernen ein Prozess gelernter Hemmung parallel zum Vergessen ist. Wenn dies zutrifft, sind Signaturen beider Prozesse auch in anderen neuronalen Strukturen, Typen und Spezies des Extinktionslernens zu erwarten (A01, A02, A04, A06, A08, A09, A14, A15). Inhibition und Vergessen als parallele Ereignisse sollten dann auch in Verhaltensdaten sichtbar sein. Die Fokusgruppe „Lerndynamik“ F01 wird ebenfalls Daten zu diesem Thema im SFB 1280 sammeln.
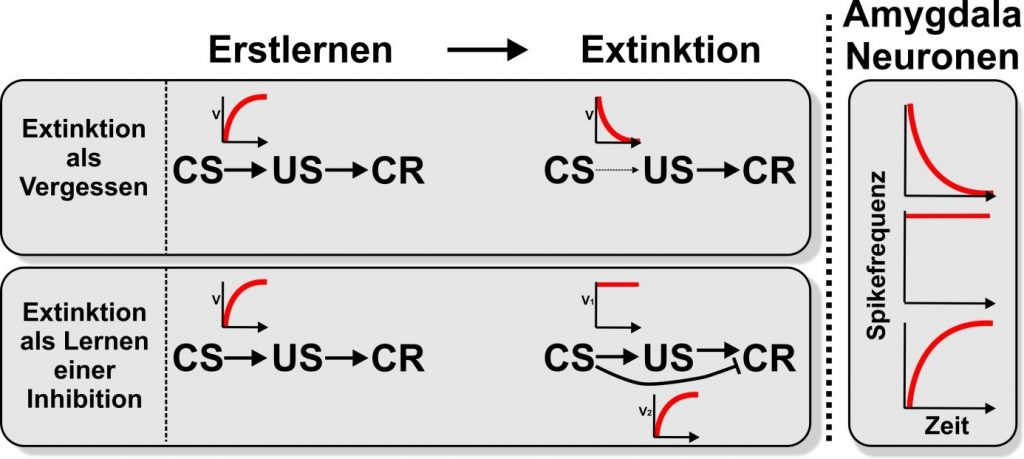
Schematische Darstellung der lerntheoretischen Vorgänge und neuronaler Antworten in der Amygdala beim initialen Erwerb sowie bei der Extinktion. Beim initialen Erwerb wird eine Assoziation zwischen dem konditionierten Stimulus (CS) und dem unkonditionierten Stimulus (US) gelernt. Dadurch wird der CS so signalhaft, dass er die konditionierte Reaktion (CR) auslöst. Die kleinen roten Kurven sollen den schematischen Verlauf der Assoziationsstärke (V) zwischen CS und US bzw. CS und CR über die Zeit darstellen.
Appetitive und aversive Extinktionsprozesse unterscheiden sich weniger auf der Verhaltensebene, können aber auf der neuronalen Ebene erheblich variieren. Die spezifische biologische Salienz von CS und US beeinflusst das exzitatorische und inhibitorische Lernen, einschließlich der Wirksamkeit von Extinktion.
Die überwiegende Mehrheit der Studien zu neuronalen Grundlagen des Extinktionslernens verwenden die Pavlov’sche Furchtkonditionierung. Einige Studien verglichen das Extinktionslernen in appetitiven und aversiven experimentellen Paradigmen, um zu untersuchen, ob die Ergebnisse der Angstkonditionierung auf die appetitive Konditionierung übertragen werden kann. Zusammengefasst zeigen appetitive und aversive Verhaltensstudien des Extinktionslernens meist überlappende Ergebnisse. Auf ähnliche Weise zeigten einige neurobiologische Studien im Menschen, dass die PFC-Aktivierung während appetitiver und aversiver operanter Konditionierung und der anschließenden Extinktion ein überlappendes Muster aufweisen: In beiden Fällen war eine erfolgreiche Extinktion mit einer erhöhten Aktivierung des frontopolaren orbitofrontalen Cortex, zudem mit einer verminderten Aktivität der Amygdala und des rechten vorderen cingulären Cortex verbunden. Es ist jedoch nicht bekannt, ob diese Ähnlichkeiten auch bei anderen gesunden Populationen und Patientengruppen bestehen. Aus diesem Grund werden im SFB 1280 mehrere Projekte zur Bildgebung des menschlichen Gehirns, Verhaltens- und neuronale Mechanismen verglichen, die dem aversiven und appetitiven Lernen in verschiedenen Populationen und Lernparadigmen zugrunde liegen (A03, A09, A11, A16).
Diese Erkenntnis ist unbedingt notwendig, denn tatsächlich werden bei einer detaillierteren Untersuchung Unterschiede beider Lernformen sichtbar. Ein wesentlicher Unterschied ist das endogene Cannabinoidsystem, das das aversive und appetitive Extinktionslernen beeinflusst indem es die Aktivität im Cortex, Hippocampus und der Amygdala unterschiedlich moduliert. Ein weiterer Unterschied zwischen den beiden Lernformen ist auf unterschiedliche Eigenschaften der dopaminergen Signalübertragung zurückzuführen. Studien zeigten, dass Dopamin-Neuronen im ventralen tegmentalen Bereich (VTA) eine phasische Anregung zeigten, nachdem sie entweder Belohnungsvorhersagen oder Primärbelohnungen ausgesetzt waren. Dies steht im Einklang mit den Modellen zur „reward prediction coding“, welche bereits von Projekt A15 untersucht wurden. GABAerge Neurone des VTA wurden wiederum durch aversive Reize angeregt und konnten anschließend dopaminerge Zellen unterdrücken. Zusätzlich sind im VTA dopaminerge Neurone vorhanden, die durch Schmerzen phasenweise angeregt werden. So wird die appetitive und aversive dopaminerge Signalübertragung durch unterschiedliche neuronale VTA-Populationen und damit möglicherweise durch zwei verschiedene Systeme vermittelt.
Die Amygdala zeigt auch unterschiedliche Aktivierungsmuster während der appetitiven oder aversiven Konditionierung. Studien belegten, dass sich die Neuronen der Amygdala bei Affen auf die appetitive oder die aversive Valenz von Reizen spezialisieren und ihre Feuerrate in Abhängigkeit mit dem Verhalten der Tiere verändern, wenn die Reizvalenz gelöscht oder umgekehrt wurde. Neurone im Hippocampus, die zur Amygdala projizieren, ändern ihr Engramm für die Gedächtnisvalenz im Einklang mit der Veränderung innerhalb der Amygdala. Die Neuronen der BLA bleiben allerdings meist auf eine Bestrafungs oder Belohnungsassoziation eingestellt. Um dieses Wissen weiter zu vertiefen, werden in der Fokusgruppe „Neuroimaging“ (F02) Daten aus aversiven und appetitiven Lernparadigmen vom Menschen hinsichtlich struktureller und funktioneller Konnektivitätsveränderungen innerhalb des Extinktionsnetzwerks als Prädiktoren für das Extinktionslernen analysiert.
Schließlich möchte der SFB 1280 eine weitere Facette des assoziativen Lernens hervorheben, die nicht durch die Dichotomie von aversiver und appetitiver Konditionierung erfasst wird: Vorbereitetsein ist hier das Stichwort und betrifft die evolutionäre Bedeutung von CS und US, die erregende und möglicherweise auch hemmende Lernprozesse prägen. Daher beeinflusst die Salienz der Reize das Lernen in Bezug auf die Latenz und Stärke der CS-US-Assoziation, das Ausmaß der konditionierten Reaktion und möglicherweise die Resistenz gegenüber der Extinktion. Mehrere Gruppen des SFB 1280 (A10, A11, A12, A13, A18) werden sich daher in einigen ihrer Experimente mit verschiedenen Arten von biologisch salienten CS oder US Reizen befassen.
Die Unterscheidung zwischen Hinweisreizen (Cues) und Kontext ist erlernt. Dieses Lernen bedarf des Hippocampuses wegen seiner Rolle bei der Speicherung von Erinnerungen an vergangene Erfahrungen. Präfrontale Mechanismen interagieren mit dem Hippocampus, um diese kontextabhängigen Erfahrungen in das Verhalten zu übersetzen.
Wie beeinflusst Kontext das Extinktionslernen?
/* Style Definitions */table.MsoNormalTable
{mso-style-name:"Normale Tabelle";
mso-tstyle-rowband-size:0;
mso-tstyle-colband-size:0;
mso-style-noshow:yes;
mso-style-priority:99;
mso-style-parent:"";
mso-padding-alt:0cm 5.4pt 0cm 5.4pt;
mso-para-margin-top:0cm;
mso-para-margin-right:0cm;
mso-para-margin-bottom:8.0pt;
mso-para-margin-left:0cm;
line-height:107%;
mso-pagination:widow-orphan;
font-size:11.0pt;
font-family:"Calibri",sans-serif;
mso-ascii-font-family:Calibri;
mso-ascii-theme-font:minor-latin;
mso-hansi-font-family:Calibri;
mso-hansi-theme-font:minor-latin;
mso-bidi-font-family:"Times New Roman";
mso-bidi-theme-font:minor-bidi;
mso-fareast-language:EN-US;}
Es gibt deutliche Hinweise darauf, dass das Extinktionslernen kontextabhängiger ist als der initiale Lernerwerb. Ohne Kontextabhängigkeit würde es keinen Renewal-Effekt im Anschluss an die Extinktion geben. Ziel des SFB 1280 ist es, die Kontextabhängigkeit zu untersuchen und dessen Verständnis zu fördern. Er wird sich dabei von drei Fragen leiten lassen:
Erstens, was ist der Kontext?
Eine Annahme ist es, dass Stimuli bestimmte Eigenschaften haben, die ihre a priori Einordnung in diskrete Hinweisreize einerseits und kontextuelle Reize andererseits ermöglichen. Beispielsweise sind Hinweisreize typischerweise diskret und können sich schnell ändern, während der Kontext als diffus und langsam wechselnd verstanden wird. Jedenfalls können mit „Kontexte [als] undefinierter Stimuli“ (Holland und Bouton 1999, S.195) und einer a priori Unterscheidung zwischen Kontexten und Hinweisreizen wichtige experimentelle Befunde nicht erklärt werden.
Eine alternative Sichtweise ist, dass es keinen kategorischen Unterschied zwischen diskreten Hinweisen und kontextuellen Informationen beim assoziativen Lernen gibt, d.h. alle sensorischen Inputs treiben das Lernen in gewissem Maße voran. Experimentelle Belege deuten darauf hin, dass der Kontext tatsächlich erlernt ist. Der SFB 1280 geht davon aus, dass die Unterscheidung zwischen Hinweisreizen und Kontext gelernt wird, d.h. Unterschiede in Kontingenz und Kontiguität, welche vom Experimentierenden implementiert sind, führen bei der Reizdarbietung zu unterschiedlichen Reaktionen. Die Darbietung eines Hinweisreizes löst die konditionierte Antwort aus, die Darbietung eines Kontextes nicht. Der Kontext hat jedoch einen modulatorischen Einfluss auf das Verhalten.
Welche Lernmechanismen liegen der Kontextabhängigkeit zugrunde?
Eine Herausforderung an die Lerntheorie ist, dass assoziative Lernmodelle in ihrer einfachsten Form kein Renewal berücksichtigen können. Lernen wird in diesen Modellen in der Regel durch eine kleine Anzahl von Darbietungen gesteuert, die zu einem bestimmten Zeitpunkt verfügbar sind. Während diese Informationen ausreichen, um das Lernen und Verlernen der starken Assoziation zwischen dem CS und dem US zu modellieren, reicht es nicht aus, die subtilere und komplexere Kontextabhängigkeit des Extinktionslernens zu beeinflussen. Das Projekt A14 wird am Rechenmodell die Hypothese testen, dass Assoziationen zwischen einem beliebigen Stimulus und den US zwar erlernt werden, aber nur starke Assoziationen mit CS können die konditionierte Reaktion hervorzurufen. Die Assoziationen zum Kontext sind zu schwach, um das Verhalten direkt zu steuern, aber ausreichend genug, um sie zu modulieren.
Drittens, was sind die neuronalen Grundlagen der Kontextabhängigkeit?
Kontextinformationen werden vermutlich vom Hippocampus bereitgestellt. Experimentelle Studien zeigen, dass eine kontextuelle Kodierung der Extinktion den Hippocampus einbezieht, während es für die klassische Konditionierung nicht unbedingt erforderlich ist. Cheng (2013) schlägt vor, dass die Beteiligung des Hippocampus für viele Bedingungen durch seine Funktion im episodenähnlichen Gedächtnis begründet wird. Der SFB 1280 geht hier wiederum davon aus, dass die Rolle des Hippocampus im episodenhaften Gedächtnis seine Rolle in der Kontextabhängigkeit des Extinktionslernens begründet. Der SFB 1280 vermutet weiter, dass die Interaktion zwischen dem Hippocampus und dem präfrontalen Cortex notwendig ist, um vergangene Erfahrungen in ein verändertes Verhalten während der Extinktion zu übersetzen (A01, A03, A04, A06, A08, A09, A10, A16).
Sensorische kortikale Felder zeigen ähnliche Extinktionslerneigenschaften wie das BLA. Diese kortikalen Felder werden auch ihre Striatalgebiete ähnlich modulieren wie die BLA ihre korrespondierenden CEA-Segmente. So verändern sich während der Extinktion Aktivitätsmuster innerhalb beider sensorisch kortikalen Gebiete als auch den korrespondierenden dorsalen Striatalen.
Die Amygdala als spezialisiertes Kortikostriatalsystem
/* Style Definitions */table.MsoNormalTable
{mso-style-name:"Normale Tabelle";
mso-tstyle-rowband-size:0;
mso-tstyle-colband-size:0;
mso-style-noshow:yes;
mso-style-priority:99;
mso-style-parent:"";
mso-padding-alt:0cm 5.4pt 0cm 5.4pt;
mso-para-margin-top:0cm;
mso-para-margin-right:0cm;
mso-para-margin-bottom:8.0pt;
mso-para-margin-left:0cm;
line-height:107%;
mso-pagination:widow-orphan;
font-size:11.0pt;
font-family:"Calibri",sans-serif;
mso-ascii-font-family:Calibri;
mso-ascii-theme-font:minor-latin;
mso-hansi-font-family:Calibri;
mso-hansi-theme-font:minor-latin;
mso-bidi-font-family:"Times New Roman";
mso-bidi-theme-font:minor-bidi;
mso-fareast-language:EN-US;}
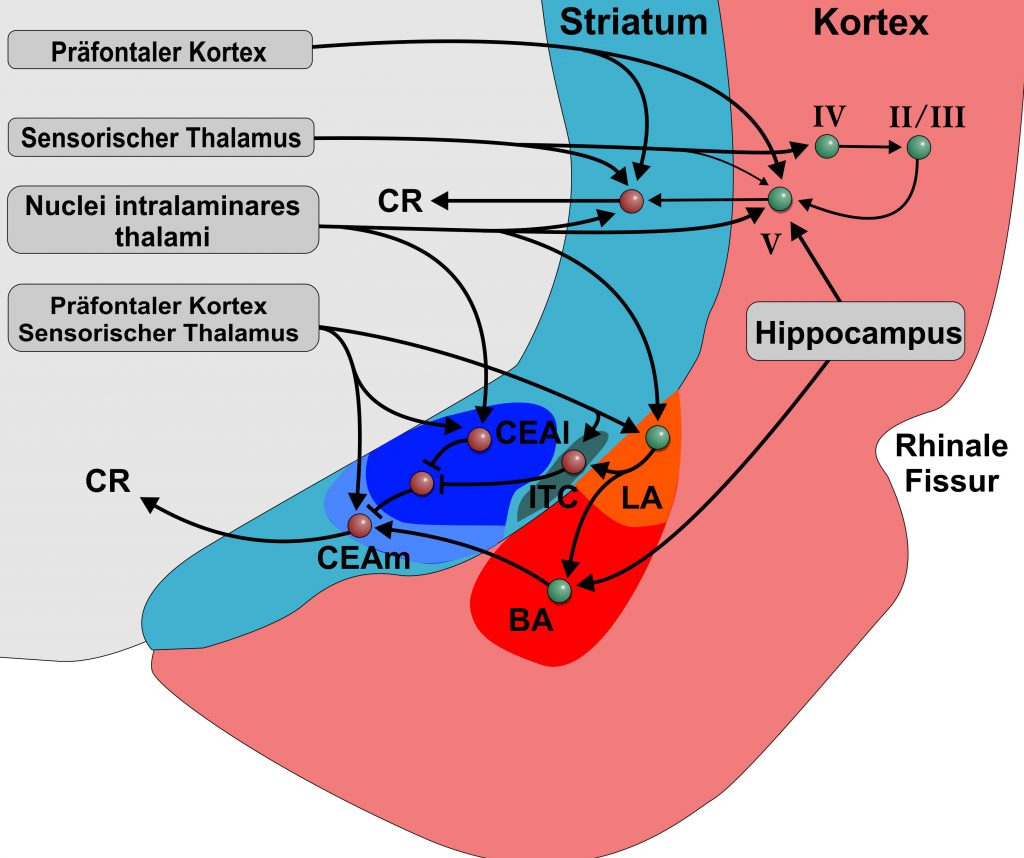
Die Amygdala ist ein spezialisierter limbischer Bestandteil, der durch seine Projektionen auf subpalliale Systeme verschiedene instinktive, emotionale und/oder affektive Verhaltensweisen steuert. Wie können die neurobiologischen Grundlagen der Amygdala-abhängigen Verarbeitung von Furchterwerb und Extinktion auf andere Formen des Extinktionslernens übertragen werden, die kognitiv sind und nicht unbedingt eine limbische Komponente beinhalten? Das BLA bildet die ventromediale Verlängerung des Claustrums, dem tiefsten Teil des insularen Cortex. Basierend auf Embryologie, Neurochemie, genetischen Analysen, Morphologie, Konnektivität und Topologie entspricht das BLA möglicherweise der Lamina V des temporalen und frontalen Cortex. Tatsächlich erhalten kortikale Lamina-V-Neuronen ebenso wie die BLA auch sensorischen Input von multimodalen intralaminären Kernen. Ähnlich wie Neuronen des BLA haben sensorische Cortexläsionen keinen Einfluss auf den Furchterwerb, sondern beeinträchtigen das Extinktionslernen und verändern die Reaktionen während des Furchterwerbs und der Extinktion. Die CEA hingegen ist aufgrund aller verfügbaren verbindungsbedingten, immunhistochemischen, topologischen und genetischen Beweise eine spezialisierte Striatalregion, die selektiv den autonomen Motorabfluss moduliert. Die meisten CEA-Neuronen sind GABAergen und nicht von mittleren stacheligen striatalen Zellen (medium spiny striatal neurons) zu unterscheiden. Tatsächlich erhält das Striatum Input von thalamischen intralaminaren Kernen, die auch auf Amygdala und Cortex projizieren. So liefern intralaminare Kerne multimodale Informationen, die Aufmerksamkeit, Orientierung und Handlung aller drei fordern: Amygdala, Striatum und Cortex. Folglich spielt das dorsale Striatum auch eine Rolle beim Erlernen der Extinktion, das mit dem der Amygdala vergleichbar ist. Der SFB 1280 geht daher davon aus, dass kortikostriatale Schaltungen beim Extinktionslernen ähnliche Eigenschaften aufweisen wie das BLA-CEA-System. Diese kortikostriatalen Schleifen entsprechen Teilen der unbekannten Gebiete des Extinktionslernens mit oder ohne limbische Beiträge und werden im SFB 1280 untersucht (A01, A02, A03, A06, A08, A09, A10, A11, A12, A16).
Normal
0
21
false
false
false
DE
X-NONE
X-NONE
table.MsoNormalTable
{mso-style-name:"Normale Tabelle";
mso-tstyle-rowband-size:0;
mso-tstyle-colband-size:0;
mso-style-noshow:yes;
mso-style-priority:99;
mso-style-parent:"";
mso-padding-alt:0cm 5.4pt 0cm 5.4pt;
mso-para-margin-top:0cm;
mso-para-margin-right:0cm;
mso-para-margin-bottom:8.0pt;
mso-para-margin-left:0cm;
line-height:107%;
mso-pagination:widow-orphan;
font-size:11.0pt;
font-family:"Calibri",sans-serif;
mso-ascii-font-family:Calibri;
mso-ascii-theme-font:minor-latin;
mso-hansi-font-family:Calibri;
mso-hansi-theme-font:minor-latin;
mso-bidi-font-family:"Times New Roman";
mso-bidi-theme-font:minor-bidi;
mso-fareast-language:EN-US;}
Schematische Darstellung der Amygdala und angrenzender kortikaler und striataler Bereiche beim Nager. Warme Farben stellen palliale/ kortikale, kalte Farben striatale Territorien dar. Römische Zahlen stellen die Cortexschichten dar. Die Afferenzen des Cortex und des Striatums sowie ihre Interkonnektivitäten zeigen große Ähnlichkeiten zu denen der pallialen und striatalen Amygdala. Die striatale Amygdala besitzt teilwiese auch pallidale Anteile. Abkürzungen: BLA: basolaterale Amygdala; CEA: centraler nucleus der Amygdala; ITC: intercalated cell cluster; LA: lateraler nucleus der Amygdala; BA: basale Amygdala; CEAl: lateraler Anteil des centralen nucleus der Amygdala; CEAm: medialer Anteil des centralen nucleus der Amygdala.
Das Cerebellum ist Teil des neuronalen Netzwerks, das verschiedenen Aspekten der Extinktion zugrunde liegt, einschließlich kontextbezogener Prozesse, konditionierter Angst und allen anderen Formen des assoziativen Lernens.
/* Style Definitions */
table.MsoNormalTable
{mso-style-name:"Normale Tabelle";
mso-tstyle-rowband-size:0;
mso-tstyle-colband-size:0;
mso-style-noshow:yes;
mso-style-priority:99;
mso-style-parent:"";
mso-padding-alt:0cm 5.4pt 0cm 5.4pt;
mso-para-margin-top:0cm;
mso-para-margin-right:0cm;
mso-para-margin-bottom:8.0pt;
mso-para-margin-left:0cm;
line-height:107%;
mso-pagination:widow-orphan;
font-size:11.0pt;
font-family:"Calibri",sans-serif;
mso-ascii-font-family:Calibri;
mso-ascii-theme-font:minor-latin;
mso-hansi-font-family:Calibri;
mso-hansi-theme-font:minor-latin;
mso-bidi-font-family:"Times New Roman";
mso-bidi-theme-font:minor-bidi;
mso-fareast-language:EN-US;}
Cerebellum – „terra incognita“ der Extinktionsforschung
/* Style Definitions */table.MsoNormalTable
{mso-style-name:"Normale Tabelle";
mso-tstyle-rowband-size:0;
mso-tstyle-colband-size:0;
mso-style-noshow:yes;
mso-style-priority:99;
mso-style-parent:"";
mso-padding-alt:0cm 5.4pt 0cm 5.4pt;
mso-para-margin-top:0cm;
mso-para-margin-right:0cm;
mso-para-margin-bottom:8.0pt;
mso-para-margin-left:0cm;
line-height:107%;
mso-pagination:widow-orphan;
font-size:11.0pt;
font-family:"Calibri",sans-serif;
mso-ascii-font-family:Calibri;
mso-ascii-theme-font:minor-latin;
mso-hansi-font-family:Calibri;
mso-hansi-theme-font:minor-latin;
mso-bidi-font-family:"Times New Roman";
mso-bidi-theme-font:minor-bidi;
mso-fareast-language:EN-US;}
Das Kleinhirn ist wahrscheinlich die größte neurale „terra incognita“ der Extinktionsforschung. Die Einflüsse vom Kleinhirn auf die Extinktion von Lidschlagkonditionierungen wurden bereits teilweise untersucht. Aber erst vor kurzem wurden neue Berichte über die Rolle des Kleinhirns bei der Extinktion erlernter Angst und bei kontextbezogenen Extinktionsprozessen veröffentlicht. Die gleiche cerebellare Verschaltung, die beim Erwerb von konditioniertem Lidschlagantworten beteiligt ist, ist möglicherweise auch an der Extinktion beteiligt. Der SFB 1280 geht davon aus, dass für den Erwerb und die Extinktion von konditionierter Angst die gleichen Prinzipien gelten. Vor allem aber ist es wahrscheinlich, dass das Cerebellum während der Extinktion von konditionierten „Eyeblinks“ mit dem Frontal-Cortex interagiert. Das Kleinhirn ist anatomisch und funktionell mit dem PFC, dem Hippocampus und der Amygdala verbunden. Da Cerebellum und Hippocampus während räumlicher Navigation interagieren, erscheint eine modulierende Rolle des Cerebellums beim Kontextlernen über hippocampaler Projektionen möglich. Alternativ kann das Cerebellum über seine Verbindungen zur dorsolateralen PFC Aufmerksamkeitsverlagerungen hin zum Kontext unterstützen. Der SFB 1280 geht davon aus, dass sich Kleinhirnbereiche, die an der Kontextverarbeitung beteiligt sind, von Kleinhirnbereichen unterscheiden, die mit dem Erlernen der Extinktion zusammenhängen. PFC und/oder Hippocampus können auch erlernte Assoziationen innerhalb des Kleinhirns hemmen, die an der Expression von konditionierten Reaktionen beteiligt sind. All dies wurde noch nie untersucht und mehrere Projekte des SFB 1280 sind speziell auf diese Fragen ausgerichtet (A05, A06). Schließlich interagieren das Kleinhirn und die Amygdala möglicherweise direkt bei der Extinktion von Angst. Diese und viele weitere Optionen sind nun mit der fortschreitenden Integration des Cerebellums in das bekannte neuronale Netzwerk des Extinktionslernens denkbar. Der SFB 1280 trägt in allen seinen humanen Bildgebungs-Projekten (A02, A03, A05, A06, A08, A09, A10, A11, A12, A16) und der Fokusgruppe „Neuroimaging“ F02 zu diesem Ansatz bei.
Neuroendokrine und immunologische Prozesse wirken sich unterschiedlich auf die Extinktionskonsolidierung und deren Abruf aus. Diese Effekte werden außerdem durch aufgabeninduzierte emotionale Erregung und Kontext moduliert. Die zugrundeliegenden Mechanismen betreffen spezifische Veränderungen im Extinktionsnetzwerk und gelten auch für erlernte Immunantworten.
Die neuroendokrine Immunschnittstelle in Extinktionsprozessen
/* Style Definitions */table.MsoNormalTable
{mso-style-name:"Normale Tabelle";
mso-tstyle-rowband-size:0;
mso-tstyle-colband-size:0;
mso-style-noshow:yes;
mso-style-priority:99;
mso-style-parent:"";
mso-padding-alt:0cm 5.4pt 0cm 5.4pt;
mso-para-margin-top:0cm;
mso-para-margin-right:0cm;
mso-para-margin-bottom:8.0pt;
mso-para-margin-left:0cm;
line-height:107%;
mso-pagination:widow-orphan;
font-size:11.0pt;
font-family:"Calibri",sans-serif;
mso-ascii-font-family:Calibri;
mso-ascii-theme-font:minor-latin;
mso-hansi-font-family:Calibri;
mso-hansi-theme-font:minor-latin;
mso-bidi-font-family:"Times New Roman";
mso-bidi-theme-font:minor-bidi;
mso-fareast-language:EN-US;}
Extinktionslernen, seine Konsolidierung und der Abruf werden von mehreren Neuromodulatoren beeinflusst. Im SFB 1280 werden Monoamine (z.B. Dopamin, Noradrenalin und Serotonin), Glukokortikoide und Immunbotenstoffe untersucht. Dopamin ist der Schlüssel zur Extinktion, da es den Kern des Vorhersagefehlers bildet. Frühere Arbeiten von Mitgliedern des SFB 1280 konnten zeigen, dass Dopamin (DA) auch das appetitive Extinktionslernen bei räumlichen Aufgaben bei Nagetieren und Menschen beeinflusst. Die Rolle von Dopamin bei der Extinktion wird daher in den Projekten A04 und A08 untersucht. Serotonin moduliert viele neuronale Funktionen wie kognitive Beurteilung und emotionale Reaktionen und wurde insbesondere mit stressbedingten affektiven Störungen in Verbindung gebracht. Überraschenderweise hat dessen Rolle für das Lernen und die Extinktion der Angst bisher wenig Beachtung gefunden. Hinweise auf die Rolle von Serotonin für den Erwerb und die Extinktion von Angst kommen aus humangenetischen und Studien am Tier, die darauf hindeuten, dass der Serotoninspiegel während einer Angstkonditionierung, psychischem Stress und dem Abruf des Angstgedächtnisses erhöht wird. Die Rolle von Serotonin bei der Modulation neuronaler Schaltkreise, die der Extinktion zugrunde liegen, wird in den Projekten A07 und A06 behandelt. A07 wird außerdem die Interaktion zwischen Stress und Serotonin bei der Modifikation der Signalkaskaden innerhalb der Amygdala während des Extinktionslernens untersuchen. Noradrenalin (NA) aus dem Locus coeruleus vermittelt den Einfluss der emotionalen Erregung auf die neuronale Erregbarkeit und ist vor allem für seine stärkende Wirkung auf Aufmerksamkeit und Gedächtniskonsolidierung bekannt. Furchtkonditionierungsstudien an Nagern haben gezeigt, dass Noradrenalin (NA) eine entscheidende Rolle bei der Extinktion von Angst spielt. Vorherige Experimente von einigen Projektleitern des SFB 1280 zeigten eine verstärkte Extinktion, wenn die NA-Konzentrationen pharmakologisch erhöht wurden, und eine beeinträchtigte Extinktion, wenn NA-Rezeptoren blockiert wurden. Die Rolle von NA für die Extinktion wird in mehreren Projekten behandelt (z.B. A04, A07, A08, A09). Das Extinktionslernen wird auch durch das neuroendokrine und periphere Immunsystem moduliert. Zwei Forschungslinien untersuchen diese Systeme im SFB 1280 gezielt in Extinktionsprozessen. Die erste betrifft Stress als potenter Modulator des Erlernens, Konsolidierens und Abruf. Die stressbedingte Aktivierung der Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) und des sympathischen Nervensystems (SNS) beeinflusst Lern- und Gedächtnisprozesse durch Modulation der Amygdala, des Hippocampus und des PFCs. Stress übt eine phasenabhängige Wirkung auf das Langzeitgedächtnis mit differenzierten Auswirkungen auf Konsolidierung und Gedächtnisabruf aus. Interessanterweise wird der Einfluss von Stress auf das Lernen durch die Emotionalität des zu lernenden Materials moduliert. Darüber hinaus durch den Kontext beeinflusst, in welchem das Lernen stattfindet, was darauf hinweist, die Auswirkungen von Stress in verschiedenen Arten von Lernparadigmen untersuchen zu müssen. In einer Reihe von Humanstudien haben Mitglieder der FOR 1581 die Auswirkungen von akutem Stress auf den Abruf der Extinktion anhand eines Renewal-Paradigmas untersucht. Deren Ergebnisse stehen im Einklang mit der Hypothese, dass je emotionaler die Gedächtnisspur angelegt ist, desto besser wirkt sich der Stress auf diese Spur aus. Diese Studien ermöglichen die klinisch orientierte Erforschung der Effekte von Stress auf Genesungsphänomene wie z.B. dem Reinstatement bei gesunden Personen und Patienten (siehe A09, A10 und A11). Faszinierende, aber bisher völlig ungeprüfte Implikationen auf Schmerz werden ebenfalls analysiert: Im Hinblick auf die Extinktionskonsolidierung konnte gezeigt werden, dass Stress nach der Extinktion zu einer eher kontextabhängigen Extinktionserinnerung führt, was mit einem stärkeren Renewal-Effekt verbunden ist. Im Gegensatz dazu macht vor der Extinktion auftretender Stress diese weniger kontextabhängig, was zu klinischen Studien passt, die die positive Auswirkungen einer Cortisol-Gabe auf Extinktions-basierende Therapien zeigen. Die Möglichkeit, durch die Verabreichung eines Stressors im Laborsetting den Extinktionserfolg zu steigern, wird im Projekt A13 getestet.
Im Hinblick auf das Immunsystem interagieren pro-inflammatorische Zytokine, die von aktivierten peripheren Immunzellen bei Entzündungen und Infektionen freigesetzt werden, mit zentralen neuronalen Systemen über humorale und vagale afferente Wege. Vorherige Arbeiten konnten kritische Hirnmechanismen charakterisieren, die bei systemischen Entzündungen in Tieren und Menschen auftreten. Über diese Verbindungen modulieren Zytokine folglich Lernen und Gedächtnis mit, allerdings ist über die Auswirkungen entzündlicher Prozesse auf das Extinktionslernen praktisch nichts bekannt. Daher wird A12 die Auswirkungen einer experimentell induzierten Entzündungsreaktion auf verschiedene Aspekte des Extinktionslernens beim Menschen untersuchen und die beteiligten afferenten Pfade und zentralen Netzwerke aufdecken. Dabei überbrückt A12 die klinischen Felder Entzündung und Schmerz, denn eine Entzündung beeinflusst sowohl die neuronale als auch subjektive Schmerzintensität. Die Verhaltenskonditionierung von Immunfunktionen stellt einen komplementären Ansatz zur Abgrenzung von ZNS-Immuninteraktionen dar. Tatsächlich können verhaltensbedingte Immunreaktionen die Schwere, den Fortschritt und die Sterblichkeitsrate bei Versuchstieren mit chronischen Entzündungskrankheiten oder Krebs beeinflussen. Relevant für den SFB 1280 ist der Befund, dass die Extinktion einer konditionierten Unterdrückung von T-Zellen-Funktionen durch Rekonsolidierung oder durch die Aktualisierung der Erinnerung aufgehoben oder sogar verhindert werden kann. Diese Daten stellen die faszinierende Perspektive zur Unterbrechung der Extinktion erlernter immunsuppressiver Effekte dar, um in klinischer Umgebung Lernparadigmen als unterstützende Therapie einzusetzen. Diese Idee ist der Ausgangspunkt von A18, mit dem das folgende Dilemma gelöst werden soll: Unter bestimmten klinischen Bedingungen werden Patienten kontinuierlich immunsuppressiv behandelt. Daher ist in diesem spezifischen klinischen Kontext die Extinktion der verhaltensbedingten Immunsuppression unerwünscht. Dies steht im Gegensatz zur Behandlung von Angststörungen und ergänzt damit andere klinisch orientierte Projekte des SFB 1280.
Das Verständnis interindividueller Variabilität und entwicklungsbedingter Veränderungen der Extinktionswirksamkeit ist entscheidend. Eine gestörte Extinktion trägt zur Pathologie und/oder zu klinisch relevanten Merkmalen bei gesunden Menschen bei.
Klinische Implikationen
Normal
0
21
false
false
false
DE
X-NONE
X-NONE
table.MsoNormalTable
{mso-style-name:"Normale Tabelle";
mso-tstyle-rowband-size:0;
mso-tstyle-colband-size:0;
mso-style-noshow:yes;
mso-style-priority:99;
mso-style-parent:"";
mso-padding-alt:0cm 5.4pt 0cm 5.4pt;
mso-para-margin-top:0cm;
mso-para-margin-right:0cm;
mso-para-margin-bottom:8.0pt;
mso-para-margin-left:0cm;
line-height:107%;
mso-pagination:widow-orphan;
font-size:11.0pt;
font-family:"Calibri",sans-serif;
mso-ascii-font-family:Calibri;
mso-ascii-theme-font:minor-latin;
mso-hansi-font-family:Calibri;
mso-hansi-theme-font:minor-latin;
mso-bidi-font-family:"Times New Roman";
mso-bidi-theme-font:minor-bidi;
mso-fareast-language:EN-US;}
Ein Verständnis der ontogenetischen Entwicklung und der interindividuellen Unterschiede in der Extinktionswirksamkeit von gesunden Probanden ist relevant für das Verständnis abnormaler Extinktion bei Patienten. Der SFB 1280 wird daher die Entwicklung des Nervensystems als Ausgangspunkt nutzen und interindividuelle Unterschiede als ein Fenster zu den Verhaltens- und neuronalen Mechanismen des Extinktionslernens nutzen, um mechanistische Erkenntnisse für klinische Anwendungen zu gewinnen. Daher wird man sich auf individuelle Unterschiede in der funktionellen und strukturellen Extinktionsnetzwerk-Aktivität und -Konnektivität konzentrieren, sowohl innerhalb spezifischer Projekte (A03, A08) als auch über alle Bildgebungsprojekte am Menschen hinweg (Fokusgruppe „Neuroimaging“ F02). Parallel dazu werden im Rahmen mehrerer Projekte der Einfluss von Geschlecht und Alter als Gruppenfaktoren auf das Extinktionslernen untersucht (A09, A10, A11, A16). Die klinisch orientierten Projekte des SFB 1280 fokussieren sich auf Angst, Schmerz und immunologische Erkrankungen. Diese Konditionen, wenn auch in ihrer klinischen Präsenz verschieden, teilen entscheidende Faktoren, die sie mit parallelen Untersuchungen bei gesunden Menschen zu interindividueller Variabilität verbinden. A09, A10 und A11 werden die Auswirkungen von akutem Stress oder Stresshormonen auf das Reinstatement bei konditionierter Angst testen. Damit werden die vorliegenden Daten über das Reinstatement von viszeralem Schmerz und somatischen schmerzbezogenen Konditionierungsparadigmen erweitert. Bei Patienten mit Angstzuständen wird in einem Projekt (A13) untersucht, ob die Anwendung eines psychosozialen Stressors vor der Expositionstherapie das therapeutische Ergebnis verbessert. Dies basiert auf Behandlungsstudien bei Angst, die gezeigt haben, dass Cortisol die Wirksamkeit der Extinktionstherapien erhöht, indem es vermutlich das ursprüngliche Angstgedächtnis hemmt und die Extinktionskonsolidierung fördert. Zusammen werden diese Ergebnisse ein differenziertes Verständnis der Mechanismen und Implikationen der Rolle von Stress beim normalem und abnormalem Extinktionslernen vermitteln.
Schließlich sind Angst, Schmerzen und Autoimmun-/Entzündungsstörungen bei Frauen häufiger als bei Männern. Dies baut auf bestehenden Einsichten über Geschlechtsunterschiede und die Rolle von Sexualhormonen aus der umfassenden Literatur der Furchtkonditionierung sowie Daten aus dem SFB 1280 auf Basis von Elektroschocks oder anderen Schmerzreizen als US auf. Die Geschlechtsunterschiede bei Angstkonditionierung und Extinktion besser zu verstehen, wird das Verständnis der zugrundeliegenden Mechanismen der Variabilität von Extinktion bei normalen und klinischen Populationen verbessern, bei denen Angst eine Rolle spielt. Es ermöglicht auch individualisierte, auf Extinktion beruhende Interventionen wie die Expositionstherapie bei der Behandlung von Angst und chronischen Schmerzen.
Quellen
Albring A, Wendt L, Benson S, Nissen S, Yavuz Z, Engler H, Witzke O, Schedlowski M (2014) Preserving learned immunosuppressive placebo response: perspectives for clinical application. Clin Pharmacol Ther. 96: 247–255.
An B, Hong I, Choi S (2012) Long-term neural correlates of reversible fear learning in the lateral amygdala. J Neurosci. 32: 16845–16856.
André MA, Manahan-Vaughan D (2015) Involvement of dopamine D1/D5 and D2 receptors in context-dependent extinction learning and memory reinstatement. Front Behav.Neurosci 9: 372
André MA, Manahan-Vaughan D (2016) Involvement of dopamine D1/D5 and D2 receptors in context-dependent extinction learning and memory reinstatement. Frontiers Behav Neurosci. 9:125. doi: 10.3389/fnbeh.2015.00125
Arbuthnott GW (2014) Thalamostriatal synapses-another substrate for dopamine action? Prog Brain Res. 211: 1–11.
Bzdok, Danilo; Laird, Angela R.; Zilles, Karl; Fox, Peter T.; Eickhoff, Simon B. (2013): An investigation of the structural, connectional, and functional subspecialization in the human amygdala. In: Human brain mapping 34 (12), S. 3247-3266. DOI: 10.1002/hbm.22138.
Benson S, Kattoor J, Kullmann JS, Hofmann S, Engler H, Forsting M, Gizewski ER, Elsenbruch S (2014) Towards understanding sex differences in visceral pain: enhanced reactivation of classically-conditioned fear in healthy women. Neurobiol Learn Mem. 109: 113–121.
Benson S, Kattoor J, Wegner A, Hammes F, Reidick D, Grigoleit J, Engler H, Oberbeck R, Schedlowski M, Elsenbruch S (2012) Acute experimental endotoxemia induces visceral hypersensitivity and altered pain evaluation in healthy humans. Pain. 153: 794–799.
Benson S, Rebernik L, Wegner A, Kleine-Borgmann J, Engler H, Schlamann M, Forsting M, Schedlowski M, Elsenbruch S (2015) Neural circuitry mediating inflammation-induced central pain amplification in human experimental endotoxemia. Brain Behav Immun. 48: 222–231.
Bocchio, M.; McHugh, S. B.; Bannerman, D. M.; Sharp, T.; Capogna, M.: Serotonin, Amygdala and Fear: Assembling the Puzzle. In: Frontiers in neuronal circuits 10 (24). DOI: 10.3389/fncir.2016.00024.
Bostan AC, Dum RP, Strick PL (2013) Cerebellar networks with the cerebral cortex and basal ganglia. Trends Cogn Sci (Regul Ed). 17: 241–254.
Bouton ME (2004) Context and behavioral processes in extinction. Learn Mem. 11: 485–494.
Bouton ME, Westbrook RF, Corcoran KA, Maren S (2006) Contextual and temporal modulation of extinction: behavioral and biological mechanisms. Biol Psychiatry. 60: 352–360.
Brischoux F, Chakraborty S, Brierley DI, Ungless MA (2009) Phasic excitation of dopamine neurons in ventral VTA by noxious stimuli. Proc Natl Acad Sci U S A. 106: 4894–4899.
Chang D, Lissek S, Ernst TM, Thürling M, Üngör M, Tegenthoff M, Ladd ME, Timmann D (2015) Cerebellar contribution to context processing in extinction learning and recall. Cerebellum. doi: 10.1007/s12311-015-0670-z.
Cheng S (2013) The CRISP theory of hippocampal function in episodic memory. Front Neural Circuits. 7: 88.
Cohen JY, Haesler S, Vong L, Lowell BB, Uchida N (2012) Neuron-type-specific signals for reward and punishment in the ventral tegmental area. Nature. 482: 85–88.
de Quervain, Dominique J-F, Bentz D, Michael T, Bolt OC, Wiederhold BK, Margraf J, Wilhelm FH (2011) Glucocorticoids enhance extinction-based psychotherapy. Proc Natl Acad Sci U S A. 108: 6621–6625.
de Quervain, Dominique J-F, Margraf J (2008) Glucocorticoids for the treatment of post-traumatic stress disorder and phobias: a novel therapeutic approach. Eur J Pharmacol. 583: 365–371.
Doig, Natalie M.; Moss, Jonathan; Bolam, J. Paul (2010): Cortical and thalamic innervation of direct and indirect pathway medium-sized spiny neurons in mouse striatum. In: The Journal of neuroscience : the official journal of the Society for Neuroscience 30 (44), S. 14610–14618. DOI: 10.1523/JNEUROSCI.1623-10.2010.
Elsenbruch S, Wolf OT (2015) Could Stress Contribute to Pain-Related Fear in Chronic Pain? Front Behav Neurosci. 9: 340.
Enck P, Bingel U, Schedlowski M, Rief W (2013) The placebo response in medicine: minimize, maximize or personalize? Nat Rev Drug Discov. 12: 191–204.
Engler H, Doenlen R, Engler A, Riether C, Prager G, Niemi M, Pacheco-López G, Krügel U, Schedlowski M (2011) Acute amygdaloid response to systemic inflammation. Brain Behav Immun. 25: 1384–1392.
Finger EC, Mitchell, Derek G V, Jones M, Blair, R J R (2008) Dissociable roles of medial orbitofrontal cortex in human operant extinction learning. Neuroimage. 43: 748–755.
Forkmann K, Wiech K, Sommer T, Bingel U (2015) Reinstatement of pain-related brain activation during the recognition of neutral images previously paired with nociceptive stimuli. Pain. 156: 1501–1510.
Gerwig M, Hajjar K, Frings M, Dimitrova A, Thilmann AF, Kolb FP, Forsting M, Timmann D (2006) Extinction of conditioned eyeblink responses in patients with cerebellar disorders. Neurosci Lett. 406: 87–91.
Grahame NJ, Hallam SC, Geier L, Miller RR (1990) Context as an occasion setter following either CS acquisition and extinction or CS acquisition alone. Learning and Motivation. 21: 237–265.
Guindon J, Hohmann AG (2009) The Endocannabinoid System and Pain. CNS Neurol Disord Drug Targets. 8: 403–421.
Haaker J, Gaburro S, Sah A, Gartmann N, Lonsdorf TB, Meier K, Singewald N, Pape HC, Morellini F, Kalisch R (2013) Single dose of L-dopa makes extinction memories context-independent and prevents the return of fear. PNAS 110: E2428-E2436.
Hadamitzky M, Engler H, Schedlowski M (2013) Learned immunosuppression: extinction, renewal, and the challenge of reconsolidation. J Neuroimmun Pharmacol. 8: 180–188.
Hagena H, Manahan-Vaughan D (2016) The serotonergic 5-HT4 receptor: a unique modulator of hippocampal synaptic information processing and cognition, Neurobiol. Learn. Mem. Jun 15. pii: S1074-7427(16)30089-2; doi: 10.1016/j.nlm.2016.06.014. [Epub ahead of print].
Hall G, Honey RC (1990) Context-specific conditioning in the conditioned-emotional-response procedure. Journal of Experimental Psychology: Animal Behavior Processes. 16: 271–278.
Hamacher-Dang TC, Engler H, Schedlowski M, Wolf OT (2013) Stress enhances the consolidation of extinction memory in a predictive learning task. Front Behav Neurosci. 7: 108.
Hamacher-Dang TC, Merz CJ, Wolf OT (2015) Stress following extinction learning leads to a context-dependent return of fear. Psychophysiology. 52: 489–498.
Harris, Kenneth D.; Shepherd, Gordon M. G. (2015): The neocortical circuit: themes and variations. In: Nature neuroscience 18 (2), S. 170-181. DOI: 10.1038/nn.3917.
Hennigan K, D’Ardenne K, McClure SM (2015) Distinct midbrain and habenula pathways are involved in processing aversive events in humans. J Neurosci. 35: 198–208.
Herry C, Ciocchi S, Senn V, Demmou L, Müller C, Lüthi A (2008) Switching on and off fear by distinct neuronal circuits. Nature. 454: 600–606.
Hirsh R (1974) The hippocampus and contextual retrieval of information from memory: A theory. Behavioral Biology. 12: 421–444.
Hobin JA, Goosens KA, Maren S (2003) Context-dependent neuronal activity in the lateral amygdala represents fear memories after extinction. J Neurosci. 23: 8410–8416.
Howlett AC, Breivogel CS, Childers SR, Deadwyler SA, Hampson RE, Porrino LJ (2004) Cannabinoid physiology and pharmacology: 30 years of progress. Neuropharmacology. 47 Suppl 1: 345–358.
Icenhour A, Langhorst J, Benson S, Schlamann M, Hampel S, Engler H, Forsting M, Elsenbruch S (2015a) Neural circuitry of abdominal pain-related fear learning and reinstatement in irritable bowel syndrome. Neurogastroenterol Motil. 27: 114–127.
Icenhour A, Kattoor J, Benson S, Boekstegers A, Schlamann M, Merz CJ, Forsting M, Elsenbruch S (2015b) Neural circuitry underlying effects of context on human pain-related fear extinction in a renewal paradigm. Hum Brain Mapp. 36: 3179–3193.
Joëls M, Pu Z, Wiegert O, Oitzl MS, Krugers HJ (2006) Learning under stress: how does it work? Trends Cogn Sci (Regul Ed). 10: 152–158.
Kattoor J, Thürling M, Gizewski ER, Forsting M, Timmann D, Elsenbruch S (2014) Cerebellar contributions to different phases of visceral aversive extinction learning. Cerebellum. 13: 1–8.
Kemp A, Manahan-Vaughan D. (2005) The 5-hydroxytryptamine4 receptor exhibits frequency-dependent properties in synaptic plasticity and behavioural metaplasticity in the hippocampal CA1 region in vivo.Cereb Cortex. 15:1037-43.
Kim JH, Richardson R (2008) The effect of temporary amygdala inactivation on extinction and reextinction of fear in the developing rat: unlearning as a potential mechanism for extinction early in development. J Neurosci. 28: 1282–1290.
Kinner VL, Merz CJ, Lissek S, Wolf OT (2016) Cortisol disrupts the neural correlates of extinction recall. Neuroimage 133: 233-243.
Labrenz F, Icenhour A, Thürling M, Schlamann M, Forsting M, Timmann D, Elsenbruch S (2015) Sex differences in cerebellar mechanisms involved in pain-related safety learning. Neurobiol Learn Mem. 123: 92–99.
Labrenz F, Icenhour A, Schlamann M, Forsting M, Bingel U, Elsenbruch S (2016) From Pavlov to pain: How predictability affects the anticipation and processing of visceral pain in a fear conditioning paradigm. Neuroimage. 130: 104-14.
Lacey, Carolyn J.; Bolam, J. Paul; Magill, Peter J. (2007): Novel and distinct operational principles of intralaminar thalamic neurons and their striatal projections. In: The Journal of neuroscience : the official journal of the Society for Neuroscience 27 (16), S. 4374–4384. DOI: 10.1523/JNEUROSCI.5519-06.2007.
Lang S, Kroll A, Lipinski SJ, Wessa M, Ridder S, Christmann C, Schad LR, Flor H (2009) Context conditioning and extinction in humans: differential contribution of the hippocampus, amygdala and prefrontal cortex. Eur J Neurosci. 29: 823–832.
Lengersdorf D, Stüttgen MC, Üngör M, Güntürkün O (2014) Transient inactivation of the pigeon hippocampus or the nidopallium caudolaterale during extinction learning impairs extinction retrieval in an appetitive conditioning paradigm. Behav Brain Res. 265: 93–100.
Lissek S, Glaubitz B, Güntürkün O, Tegenthoff M (2015) Noradrenergic stimulation modulates activation of extinction-related brain regions and enhances contextual extinction learning without affecting renewal. Front Behav Neurosci. 9: 34.
Lissek S, Glaubitz B, Üngör M, Tegenthoff M (2013) Hippocampal activation during extinction learning predicts occurrence of the renewal effect in extinction recall. Neuroimage. 81: 131–143.
Lissek S, Glaubitz B, Schmidt-Wilcke T, Tegenthoff M (2016) Hippocampal Context Processing during Acquisition of a Predictive Learning Task Is Associated with Renewal in Extinction Recall. J Cogn Neurosci 28:5 747–762.
Lissek S, Glaubitz B, Wolf OT, Tegenthoff M (2015b) The DA antagonist tiapride impairs context-related extinction learning in a novel context without affecting renewal. Front Behav Neurosci 9: 238.
Lonsdorf TB, Kalisch R (2011) A review on experimental and clinical genetic associations studies on fear conditioning, extinction and cognitive-behavioral treatment. Transl Psychiatry 1: e41.
Lucke S, Lachnit H, Koenig S, Üngör M (2013) The informational value of contexts affects context-dependent learning. Learn Behav. 41: 285–297.
Lucke S, Lachnit H, Stüttgen MC, Üngör M (2014) The impact of context relevance during extinction learning. Learn Behav. 42: 256–269.
Magal A, Mintz M (2014) Inhibition of the amygdala central nucleus by stimulation of cerebellar output in rats: a putative mechanism for extinction of the conditioned fear response. Eur J Neurosci. 40: 3548–3555.
Mallan KM, Lipp OV, Cochrane B (2013) Slithering snakes, angry men and out-group members: what and whom are we evolved to fear? Cogn Emot. 27: 1168–1180.
Maren S, Chang C (2006) Recent fear is resistant to extinction. Proc Natl Acad Sci U S A. 103: 18020–18025.
Maren, Stephen; Holmes, Andrew (2016): Stress and Fear Extinction. In: Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology 41 (1), S. 58-79. DOI: 10.1038/npp.2015.180.
Maruki K, Izaki Y, Akema T, Nomura M (2003) Effects of acetylcholine antagonist injection into the prefrontal cortex on the progress of lever-press extinction in rats. Neurosci Lett. 351: 95–98.
Matsumoto M, Hikosaka O (2007) Lateral habenula as a source of negative reward signals in dopamine neurons. Nature. 447: 1111–1115.
McGaugh JL, Roozendaal B (2002) Role of adrenal stress hormones in forming lasting memories in the brain. Curr Opin Neurobiol 12: 205-210.
McHaffie JG, Stanford TR, Stein BE, Coizet V, Redgrave P (2005) Subcortical loops through the basal ganglia. Trends Neurosci. 28: 401–407.
Medina JF, Nores WL, Mauk MD (2002) Inhibition of climbing fibres is a signal for the extinction of conditioned eyelid responses. Nature. 416: 330–333.
Meir Drexler S, Merz CJ, Hamacher-Dang TC, Tegenthoff M, Wolf OT (2015) Effects of Cortisol on Reconsolidation of Reactivated Fear Memories. Neuropsychopharmacology. doi: 10.1038/npp.2015.160
Merz CJ, Hamacher-Dang TC, Wolf OT (2014) Exposure to stress attenuates fear retrieval in healthy men. Psychoneuroendocrinology. 41: 89–96.
Merz CJ, Hermann A, Stark R, Wolf OT (2014) Cortisol modifies extinction learning of recently acquired fear in men. Soc Cogn Affect Neurosci. 9: 1426–1434.
Merz CJ, Tabbert K, Schweckendiek J, Klucken T, Vaitl D, Stark R, Wolf OT (2012) Oral contraceptive usage alters the effects of cortisol on implicit fear learning. Horm Behav. 62: 531–538.
Merz CJ, Wolf OT, Schweckendiek J, Klucken T, Vaitl D, Stark R (2013) Stress differentially affects fear conditioning in men and women. Psychoneuroendocrinology. 38: 2529–2541.
Minai AA, Barrows GL, Levy WB (1994) Disambiguation of pattern sequences with recurrent networks. In International Neural Network Society (Boston) (Ed.) World Congress on Neural Networks. Boston, Hillsdale NJ : L. Erlbaum: 176–181.
Morris RW, Bouton ME (2007) The effect of yohimbine on the extinction of conditioned fear: a role for context. Behav Neurosci 121:, 501-514.
Mühlberger A, Wiedemann G, Herrmann MJ, Pauli P (2006) Phylo- and ontogenetic fears and the expectation of danger: differences between spider- and flight-phobic subjects in cognitive and physiological responses to disorder-specific stimuli. J Abnorm Psychol. 115: 580–589.
Myers CE, Gluck MA (1994) Context, conditioning, and hippocampal rerepresentation in animal learning. Behav Neurosci. 108: 835–847.
Nadel L, Willner J (1980) Context and conditioning: A place for space. Psychobiology. 8: 218–228.
Nakajima S, Tanaka S, Urushihara K, Imada H (2000) Renewal of Extinguished Lever-Press Responses upon Return to the Training Context. Learning and Motivation. 31: 416–431.
Namburi P, Beyeler A, Yorozu S, Calhoon GG, Halbert SA, Wichmann R, Holden SS, Mertens KL, Anahtar M, Felix-Ortiz AC, Wickersham IR, Gray JM, Tye KM (2015) A circuit mechanism for differentiating positive and negative associations. Nature. 520: 675–678.
Nemeroff CB (2002) Recent advances in the neurobiology of depression. Psychopharmacol Bull 36 Suppl 2: 6-23.
Ohman, A.; Mineka, S. (2001): Fears, phobias, and preparedness: toward an evolved module of fear and fear learning. In: Psychological review 108 (3), S. 483-522.
O’Keefe J, Dostrovsky J (1971) The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat. Brain Research. 34: 171–175.
Pabba, Mohan (2013): Evolutionary development of the amygdaloid complex. In: Frontiers in neuroanatomy 7, S. 27. DOI: 10.3389/fnana.2013.00027.
Pape H, Pare D (2010) Plastic synaptic networks of the amygdala for the acquisition, expression, and extinction of conditioned fear. Physiol Rev. 90: 419–463.
Parent M, Parent A (2005) Single-axon tracing and three-dimensional reconstruction of centre median-parafascicular thalamic neurons in primates. J Comp Neurol. 481: 127–144.
Paton JJ, Belova MA, Morrison SE, Salzman CD (2006) The primate amygdala represents the positive and negative value of visual stimuli during learning. Nature. 439: 865–870.
Petrovich GD, Canteras NS, Swanson LW (2001) Combinatorial amygdalar inputs to hippocampal domains and hypothalamic behavior systems. Brain Research Reviews. 38: 247–289.
Prager G, Hadamitzky M, Engler A, Doenlen R, Wirth T, Pacheco-López G, Krügel U, Schedlowski M, Engler H (2013) Amygdaloid signature of peripheral immune activation by bacterial lipopolysaccharide or staphylococcal enterotoxin B. J Neuroimmune Pharmacol. 8: 42–50.
Quirk GJ, Russo GK, Barron JL, Lebron K (2000) The role of ventromedial prefrontal cortex in the recovery of extinguished fear. J Neurosci. 20: 6225–6231.
Redish AD, Jensen S, Johnson A, Kurth-Nelson Z (2007) Reconciling reinforcement learning models with behavioral extinction and renewal: implications for addiction, relapse, and problem gambling. Psychological Review. 114: 784–805.
Redondo RL, Kim J, Arons AL, Ramirez S, Liu X, Tonegawa S (2014) Bidirectional switch of the valence associated with a hippocampal contextual memory engram. Nature. 513: 426–430.
Rescorla RA (2004) Spontaneous recovery varies inversely with the training-extinction interval. Animal Learning & Behavior. 32: 401–408.
Rescorla RA (2008) Within-subject renewal in sign tracking. Q J Exp Psychol (Hove). 61: 1793–1802.
Rescorla RA, Wagner AR (1972) A theory of Pavlovian conditioning: Variations in the effectiveness of reinforcement and nonreinforcement. In Black, AH, Prokasy, WF (Ed.) Appleton-Century-Crofts: 64–99.
Rhodes, Sarah E V, Killcross S (2004) Lesions of rat infralimbic cortex enhance recovery and reinstatement of an appetitive Pavlovian response. Learn Mem. 11: 611–616.
Roozendaal B, McEwen BS, Chattarji S (2009) Stress, memory and the amygdala. Nat Rev Neurosci. 10: 423–433.
Schedlowski M, Enck P, Rief W, Bingel U (2015) Neuro-Bio-Behavioral Mechanisms of Placebo and Nocebo Responses: Implications for Clinical Trials and Clinical Practice. Pharmacol Rev. 67: 697–730.
Schedlowski M, Pacheco-López G (2010) The learned immune response: Pavlov and beyond. Brain Behav Immun. 24: 176–185.
Schiller D, Levy I, Niv Y, Ledoux JE, Phelps EA (2008) From fear to safety and back: reversal of fear in the human brain. J Neurosci. 28: 11517–11525.
Schmidt K, Forkmann K, Sinke C, Gratz M, Bitz A, Bingel U. (2016) The differential effect of trigeminal vs. peripheral pain stimulation on visual processing and memory encoding is influenced by pain-related fear. Neuroimage. Jul 1;134:386-95.
Schultz W (2016) Dopamine reward prediction-error signalling: a two-component response. Nat Rev Neurosci 17: 183-195.
Seehagen S, Schneider S, Rudolph J, Ernst S, Zmyj N (2015) Stress impairs cognitive flexibility in infants. Proc Natl Acad Sci USA. 112(41):12882–128826.
Shabel SJ, Janak PH (2009) Substantial similarity in amygdala neuronal activity during conditioned appetitive and aversive emotional arousal. Proc Natl Acad Sci U S A. 106: 15031–15036.
Song EY, Boatman JA, Jung MW, Kim JJ (2010) Auditory Cortex is Important in the Extinction of Two Different Tone-Based Conditioned Fear Memories in Rats. Front Behav Neurosci. 4: 24.
Sotres-Bayon F, Cain CK, Ledoux JE (2006) Brain mechanisms of fear extinction: historical perspectives on the contribution of prefrontal cortex. Biol Psychiatry. 60: 329–336.
Spoida K, Masseck OA, Deneris ES, Herlitze S (2014) Gq/5-HT2c receptor signals activate a local GABAergic inhibitory feedback circuit to modulate serotonergic firing and anxiety in mice. PNAS 111: 6479-6484.
Starosta S, Bartetzko I, Lucke S, Uengoer M, Güntürkün O, Stüttgen MC (2016) Context-specificity of both acquisition and extinction of a Pavlovian conditioned response, Learning and Memory, October 17 [EPub].
Stockhorst U, Antov MI (2015) Modulation of Fear Extinction by Stress, Stress Hormones and Estradiol: A Review. Front Behav Neurosci 9: 359.
Sutton RS, Barto AG (1987) A temporal-difference model of classical conditioning. Proc Annu Conf Cogn Sci Soc: 355–378.
Swanson LW, Petrovich GD (1998) What is the amygdala? Trends Neurosci. 21: 323–331.
Thürling M, Kahl F, Maderwald S, Stefanescu RM, Schlamann M, Boele H, De Zeeuw, Chris I, Diedrichsen J, Ladd ME, Koekkoek, Sebastiaan K E, Timmann D (2015) Cerebellar cortex and cerebellar nuclei are concomitantly activated during eyeblink conditioning: a 7T fMRI study in humans. J Neurosci. 35: 1228–1239.
Tracey KJ (2010) Understanding immunity requires more than immunology. Nat Immunol. 11: 561–564.
Utz A, Thurling M, Ernst TM, Hermann A, Stark R, Wolf OT, Timmann D, Merz CJ (2015) Cerebellar vermis contributes to the extinction of conditioned fear. Neurosci Lett. 604: 173–177.
Viviani, Daniele; Charlet, Alexandre; van den Burg, Erwin; Robinet, Camille; Hurni, Nicolas; Abatis, Marios et al. (2011): Oxytocin selectively gates fear responses through distinct outputs from the central amygdala. In: Science (New York, N.Y.) 333 (6038), S. 104-107. DOI: 10.1126/science.1201043.
Wegner A, Elsenbruch S, Maluck J, Grigoleit J, Engler H, Jager M, Spreitzer I, Schedlowski M, Benson S (2014) Inflammation-induced hyperalgesia: effects of timing, dosage, and negative affect on somatic pain sensitivity in human experimental endotoxemia. Brain Behav Immun. 41: 46–54.
Williams AE, Rhudy JL (2007) The influence of conditioned fear on human pain thresholds: does preparedness play a role? J Pain. 8: 598–606.
Wolf OT (2009) Stress and memory in humans: twelve years of progress? Brain Research. 1293: 142–154.
Woods AM, Bouton ME (2008) Immediate extinction causes a less durable loss of performance than delayed extinction following either fear or appetitive conditioning. Learn Mem. 15: 909–920.